L’industrie pharmaceutique figure parmi celles qui déploient les efforts de R&D les plus importants (environ 10% de son CA, contre 5% en moyenne tous secteurs confondus). Et pour cause, ses processus de R&D sont généralement longs (entre 10 et 12 ans), coûteux (environ 1,5 milliards de dollars en moyenne par médicament) et se heurtent à d’importants risques d’échecs (Sur 10000 molécules criblées, 10 seulement feront l’objet d’un dépôt de brevet, une seule deviendra un médicament).
De plus, alors que les dépenses de R&D augmentent très nettement depuis plusieurs décennies, le nombre de nouveaux médicaments approuvés chaque année stagne voire diminue. Autrement dit, l’efficience des processus de R&D dans l’industrie pharmaceutique est en constante diminution. Plus précisément, tous les 9 ans, le nombre de médicaments approuvés par milliard de dollars dépensé diminue de moitié. Ce phénomène est appelé « Loi d’Eroom » en référence à la célèbre loi de Moore. Il s’agit d’un sujet de préoccupation majeur pour les laboratoires car il en découle une forte baisse de la rentabilité de leurs investissements en matière de R&D, passant notamment de 10,1% en 2010 à 3,2% en 2017.
Dans le même temps, les techniques d’Intelligence Artificielle (IA) ne cessent de se perfectionner et sont de plus en plus sollicitées pour traiter l’ensemble des étapes des processus de R&D pharmaceutique. Dans cet article, nous discutons des possibilités d’application de l’IA aux processus de R&D pharmaceutique et ouvrons la réflexion sur des types d’actions que les laboratoires pourraient prendre en vue de penser au mieux l’intégration du digital et de l’IA dans leurs futurs modèles.
Pourquoi une telle diminution de l'efficience des processus de R&D ?
Dans la littérature, quatre raisons principales sont généralement avancées :
- Difficulté de recours à l’innovation incrémentale : Les nouveaux médicaments présentent souvent un bénéfice incrémental modeste par rapport aux médicaments existants. Démontrer leur supériorité suppose, pour atteindre la significativité, de procéder à des protocoles longs et donc coûteux.
- Durcissement des régulations : Les exigences des autorités de régulation tendent à se durcir au cours du temps, se traduisant par un risque d’échec accru.
- Tendance au surinvestissement : Il existe une tendance à injecter toujours plus de moyens dans les processus de R&D sans ce cela n’ait nécessairement d’impact positif sur leurs résultats.
- Diminution de recours aux tests expérimentaux : Avec les avancées technologiques connues dans les étapes de recherche exploratoire, les candidats médicaments sont de plus en plus souvent identifiés via la recherche fondamentale (modèles in silico, prédictions…) et moins par l’intermédiaire de méthodes expérimentales (tests in vitro, in vivo…). Ceci conduirait à une surestimation de la capacité des candidats médicaments à passer les tests cliniques.
Quels enjeux pour les laboratoires pharmaceutiques ?
Face à la baisse de l’efficience des processus de R&D pharmaceutique qui érodent la rentabilité de leurs investissements, les laboratoires sont conduits à prendre – ou à envisager – plusieurs types d’actions :
- Sous-traitance auprès d’acteurs spécialisés : Alors que le marché mondial pour la sous-traitance des activités de R&D dans l’industrie pharmaceutique atteignait 14,9 milliards de dollars en 2014, il est de l’ordre de 25 milliards en 2018 d’après PharmTech. Sur les étapes en amont (recherche exploratoire), les laboratoires ont principalement recours à des startups ou des sociétés de biotechnologie. Sur les étapes plus en aval (essais cliniques), les CRO[1] sont généralement sollicités.
- Recherche collaborative : Les types de collaborations peuvent être multiples ; elles peuvent impliquer les laboratoires et d’autres types d’acteurs comme ceux du milieu universitaire, les sociétés de biotechnologie, les startups, voire d’autres laboratoires pharmaceutiques (plusieurs partenariats de ce type ont été noués dans le cadre de la recherche d’un vaccin contre la pandémie de COVID-19).
- Réduction des moyens alloués à la R&D : Ces dernières années, plusieurs laboratoires pharmaceutiques ont été contraints de réduire leurs dépenses de R&D (fermetures de sites, réduction d’effectifs…). Parfois, la réduction des moyens alloués à la R&D peut s’accompagner de certaines formes de délocalisation.
- Développement d’une politique d’aversion au risque : Les coûts de R&D étant en grande partie imputables aux coûts des échecs, les laboratoires pharmaceutiques abandonnent de plus en plus précocement des projets susceptibles d’échouer en aval de la chaîne des processus de R&D.
- Compensation des pertes par des opérations de fusion ou d’acquisition : Ces opérations visent à bénéficier de la croissance dynamique de structures plus petites (startups ou sociétés de biotechnologies) en plus d’acquérir certaines compétences leur faisant jusque-là défaut. Rien que sur l’année 2018, le paysage de l’industrie pharmaceutique a compté des dizaines d’opérations notables de ce type.
- Développement de nouvelles méthodes d’innovation : Les laboratoires multiplient les initiatives en faveur de la promotion des pratiques innovantes au sein de leurs unités. On assite à la création de plusieurs labs d’innovation numérique par de grands laboratoires avec l’objectif de relever les défis du digital, diffuser des bonnes pratiques en interne, et tirer parti des nouvelles méthodes d’innovation.
Ainsi, les conséquences potentielles ou effectives de la baisse de l’efficience des processus de R&D pharmaceutique soulèvent des questions de taille pour les laboratoires. Notamment, la baisse des ressources allouées aux processus de R&D (sous-traitance, suppression d’une partie des effectifs…) tend à fragiliser leur positionnement sur la chaîne de valeur, les contraignant à la poursuite d’activités de plus en plus avales.
[1] Contract Research Organisation
L'IA tend à disrupter les étapes de R&D pharmaceutique
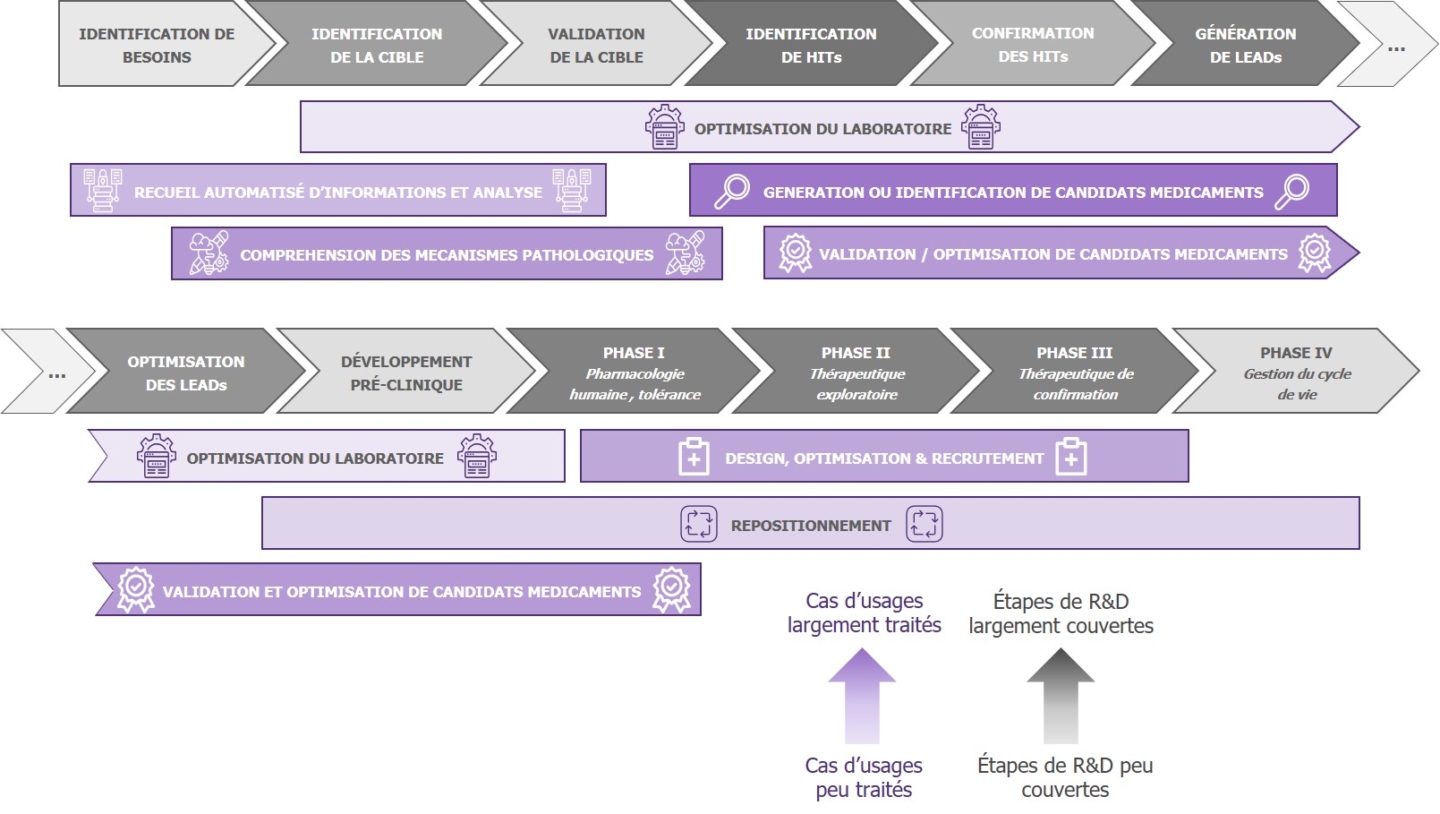
Les activités de R&D sont traditionnellement structurées en une douzaine d’étapes pouvant être suivies avec plus ou moins de linéarité. Ces étapes forment trois grands blocs : la recherche exploratoire (identification des besoins, identification et validation de la cible, identification et confirmation du hit, génération et optimisation des composés lead…), les essais pré-cliniques (études pharmacologiques et toxicologiques sur des animaux…) et les tests cliniques (phases I à IV).
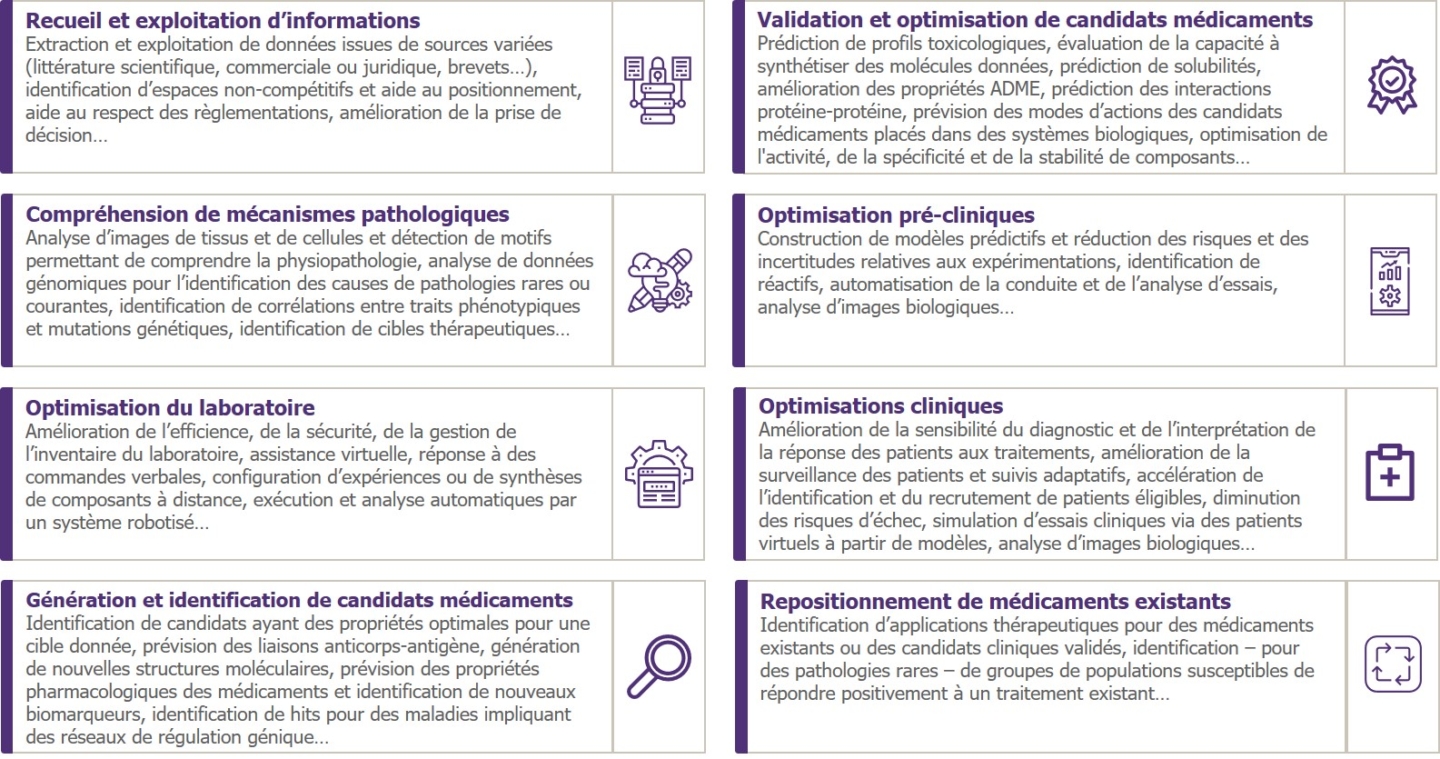
Pour chacune de ces étapes, on retrouve de nombreux cas d’application de l’Intelligence Artificielle. Ces cas d’usage, comme tous les cas d’usage dans lesquels l’Intelligence Artificielle est sollicitée, servent au moins l’un de ces trois objectifs : « comprendre » (des relations, des corrélations ou des structurations dans des jeux de données complexes), « prédire » (des résultats ou tendances à partir de comportements passés) ou « générer » (de nouvelles caractéristiques au travers de processus créatifs). Nous les avons regroupés en huit grandes familles :
Afin de nous faire une idée des tendances du marché, nous nous somme intéressés à la manière dont les startups se saisissent de ces différents cas d’usage. Pour cela, nous avons identifié une centaine de startups mettant l’IA au service des processus de R&D pharmaceutique. Pour chacune d’elle, nous avons identifié les étapes de R&D couvertes par leurs solutions ainsi que les familles de cas d’usage traités correspondantes. Nous avons ensuite dénombré, au global, le total des étapes couvertes et des familles de cas d’usage traités afin d’obtenir une photographie des tendances actuelles. Nous obtenons ainsi la carte des tendances suivante :
Analyse et interprétation :
- Génération et l’identification de candidats médicaments : La bonne représentation des startups est probablement due à la montée en puissance des techniques de Deep Learning ces dernières années, et en particulier à l’apparition progressive de modèles capables de faire preuve de force de proposition comme les GANs. Pour la première fois, les algorithmes deviennent créatifs.
- Identification du hit : La bonne représentation des startups sur cette étape s’explique probablement par la possibilité d’utiliser des bases de données publiques pour entraîner les modèles, ce qui diminue la dépendance des startups vis-à-vis des laboratoires pharmaceutiques et des sociétés de biotechnologie.
- Optimisation des leads : Si les startups sont bien représentées, cela est dû à ce que cette étape représente un enjeu économique fort (environ la moitié des dépenses de recherche exploratoire). Cependant, les startups positionnées sur ce type de cas d’usage traitent généralement surtout avec des sociétés de biotechnologie de taille modeste, et très peu avec les grands laboratoires, en raison des importants enjeux liés à la Propriété Intellectuelle.
- Développement pré-clinique : Les startups sont peu représentées sur cette étape, probablement car elle ne constitue que 12% des dépenses totales en matière de R&D. C’est également une étape courte par rapport aux autres (0,8 an en moyenne). De plus, comme elle implique principalement des études pharmacologiques et toxicologiques sur des animaux comme prérequis pour passer aux tests cliniques, les leviers présentés par le digital et l’Intelligence Artificielle sont moindres par rapport aux autres étapes.
- Phases cliniques : Les startups sont de mieux en mieux représentées. Il s’agit en effet des étapes de R&D les plus onéreuses et les plus longues, c’est donc là que le marché potentiel est le plus grand.
Laboratoires pharmaceutiques : Comment penser l'intégration de l'IA et du digital dans leurs futurs modèles ?
Face à cette baisse de l’efficience de leurs processus de R&D, nous pensons que les laboratoires pharmaceutiques doivent faire preuve de réactivité en tirant parti des nouvelles possibilités offertes par le digital et l’Intelligence Artificielle afin de sécuriser et consolider leur positionnement sur la chaîne de valeur du médicament. Alors qu’il leur est parfois reproché de reposer sur des modèles conservateurs et peu axés sur les nouvelles pratiques, certains laboratoires ont déjà commencé à se mobiliser pour engager les transformations nécessaires. Dans cette perspective, nous ouvrons ici la réflexion sur des types d’actions en lien avec l’IA que pourraient prendre dès à présent les laboratoires pour préparer au mieux leurs futurs modèles.
- Diffuser largement en interne les bonnes pratiques autour des données : Si les laboratoires pharmaceutiques disposent de larges quantités de données, elles ne sont pas systématiquement labélisées et stockées de manière à pouvoir les exploiter avec les méthodes modernes de Data Science. Un travail conséquent de diffusion des bonnes pratiques en interne reste parfois à opérer.
- Organiser l’audit et la modernisation des systèmes d’information : L’exploitabilité des données est également conditionnée par la qualité des systèmes d’information dans lesquelles elles transitent. La modernisation de ces systèmes s’impose pour intégrer davantage les enjeux liés à la collecte et la circulation des données. Les solutions devront être adressées sur mesure, intégrant pleinement les enjeux spécifiques de confidentialité et de sécurité en lien avec la protection de la Propriété Intellectuelle (PI) des laboratoires.
Cette boussole du digital prendrait la forme d’un tableau de bord servant de guide aux laboratoires dans leurs décisions d’investissement, d’acquisition, ou de développement de leurs activités de R&D. Elle reposera sur des indicateurs tangibles, toujours maintenus à jour, tels que :
- Les meilleurs modèles disponibles sur le marché (quels modèles d’IA sont généralement utilisés pour aborder tel ou tel cas d’usage ? Sur quelles technologies reposent-ils ? Quelles sont leurs limites ?)
- Le potentiel d’optimisation des étapes de R&D pour chacun des modèles (quelle diminution des risques ? Quelle réduction des coûts ? Quelle réduction de la durée ?) de façon qualitative et surtout quantitative
- Les technologies ou modèles émergents (des technologies rencontrées dans la littérature qui ne sont pas encore industrialisables mais qui présentent des perspectives encourageantes)
La boussole qui rendra le plus fidèlement compte de ces différents critères sera celle qui pointera vers les décisions les plus rentables et les moins risquées pour les laboratoires.
Les enjeux de Propriété Intellectuelle dans l’industrie pharmaceutique ont beaucoup conduit les grands laboratoires à mener leurs travaux de R&D de manière isolée. Seulement, avec le foisonnement de nouvelles technologies et l’augmentation de la complexité associée à leur appropriation, une forte capacité d’innovation implique de tendre vers des modèles basés sur de la surspécialisation. Dans la course à l’innovation, les laboratoires, lorsqu’ils ne reposent que sur leurs propres mécanismes d’innovation interne, rencontrent donc parfois des difficultés à tenir la distance face à des startups surspécialisées. Face à ce constat, les laboratoires ont intérêt à collaborer avec ces acteurs dont le nombre va croissant.
Seulement, ces collaborations ne devront pas se faire au détriment du développement en propre car nous considérons l’Intelligence Artificielle comme un futur levier de différenciation majeur. Les laboratoires devront donc trouver des modèles de collaboration équilibrés, en se prémunissant au maximum de tendre vers formes de sous-traitance de la partie recherche. Le développement en propre pourra en particulier être privilégié sur les étapes amont des processus de R&D, là où les enjeux de Propriété Intellectuelle sont les plus forts.
Lorsque ni le développement en propre, ni la collaboration équilibrée ne peut sembler envisageable, l’acquisition de la startup peut constituer une réponse pertinente sous réserve qu’il lui soit laissé un certain degré d’indépendance, garante de la préservation de sa capacité à disrupter.
Si les modèles basés sur la collaboration peuvent être une réponse pour améliorer l’efficience des processus de R&D des laboratoires, cette pratique est conditionnée par une facilitation des échanges des données. Compte tenu de leur sensibilité et des problématiques liées à la Propriété Intellectuelle, davantage d’échanges de données ne pourra se faire qu’au prix de larges efforts effectués en faveur de leur sécurisation.
- En ce sens, la blockchain pourrait constituer à terme une forme de solution. Ce type de technologie permettrait de sécuriser les échanges de données entre les laboratoires pharmaceutiques et les acteurs avec qui ils collaborent, de sorte que les problématiques de Propriété Intellectuelle ne soient plus de nature à les limiter dans leurs démarches d’innovation. Dans cette configuration, un consortium de petits acteurs gravitant autour des laboratoires pharmaceutiques pourrait entraîner ses modèles à partir de données mises à disposition de façon sécurisée, fiable, chiffrée, historicisée voire confidentielle par les laboratoires pharmaceutiques.
- Avec ces solutions, on peut même envisager un modèle économique au sein duquel les laboratoires pharmaceutiques monétiseraient la mise à disposition de leurs chimiothèques pour l’entrainement des modèles d’autres entreprises.
La Propriété Intellectuelle constitue un enjeu de taille pour les laboratoires pharmaceutiques. En effet, leur business model est en partie axé sur la constitution d’un patrimoine de molécules brevetées leur permettant, sur toute la durée de validité du brevet (une vingtaine d’années), d’exploiter commercialement les médicaments associés. Lorsque le brevet n’est plus valide, des concurrents peuvent alors commercialiser des médicaments dits « génériques », c’est-à-dire identiques ou équivalents au médicament original mais généralement vendus moins cher. Le laboratoire voit alors ses bénéfices chuter.
Pour cela, nous pensons que la stratégie du « repositionnement » de médicament doit être favorisée par les laboratoires pharmaceutiques car :
- Le repositionnement de molécules existantes peut permettre d’étendre la durée de validité des brevets et donc la durée de commercialisation des molécules concernées. Cela est d’autant plus important que les laboratoires sont en train de connaître un phénomène massif d’expiration des brevets (patent cliff) protégeant leurs molécules blockbuster.
- L’IA est très adaptée pour répondre à ces besoins. Elle peut par exemple être entrainée à partir de larges bases de données hétérogènes rendant compte d’associations et de corrélations connues entre des cibles et des molécules, des médicaments et des pathologies afin de faire des prédictions sur les interactions d’une molécule donnée avec d’autres cibles que celle pour laquelle elle a été initialement développée.